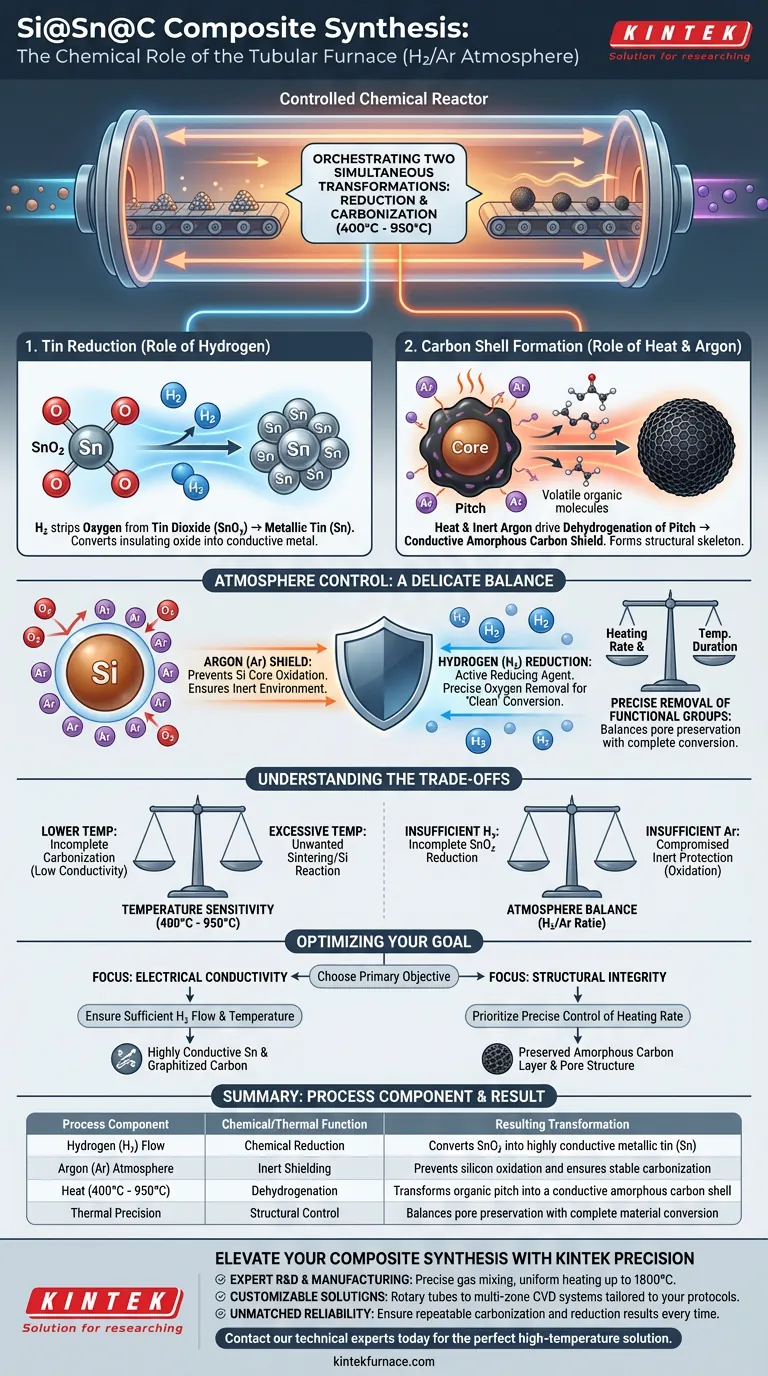
Le four tubulaire fonctionne comme un réacteur chimique contrôlé, orchestrant deux transformations simultanées : la réduction des oxydes métalliques et la carbonisation des précurseurs organiques. En maintenant une atmosphère spécifique d'hydrogène/argon entre 400 °C et 950 °C, le four permet la synthèse d'une architecture ternaire Si@Sn@C hautement conductrice.
Point essentiel à retenir Le four utilise le composant hydrogène pour dépouiller chimiquement l'oxygène de l'oxyde d'étain (SnO2) afin de former de l'étain métallique, tandis que l'environnement thermique sous argon inerte convertit la couche de brai en un blindage de carbone amorphe conducteur. Ce double processus crée une structure composite stable et conductrice.

Le double mécanisme chimique
Le four tubulaire n'est pas simplement un élément chauffant ; il fournit l'environnement précis requis pour que deux réactions chimiques distinctes se produisent en parallèle.
1. La réduction de l'étain (Le rôle de l'hydrogène)
Le rôle chimique principal de l'atmosphère du four est la réduction.
Le matériau précurseur contient du dioxyde d'étain (SnO2). Le four introduit du gaz hydrogène (H2) qui réagit avec l'oxygène du SnO2.
Cette réaction élimine l'oxygène, convertissant l'oxyde semi-conducteur ou isolant en étain métallique (Sn). Cette conversion est essentielle pour garantir que le composite final possède les propriétés métalliques nécessaires à une conductivité élevée.
2. La formation de la coque de carbone (Le rôle de la chaleur et de l'argon)
Simultanément, le four gère la carbonisation du revêtement extérieur.
La couche de "brai" entourant le matériau est un précurseur organique. Sous la protection d'un gaz argon inerte, les hautes températures (400 °C – 950 °C) provoquent un processus appelé déshydrogénation.
Cela élimine les éléments non carbonés du brai, le transformant en une couche de carbone amorphe hautement conductrice. Cette couche agit comme un squelette structurel pour le composite final.
L'importance du contrôle de l'atmosphère
Le succès de cette synthèse repose sur la séparation stricte des fonctions chimiques assurée par le mélange gazeux.
Prévention de l'oxydation indésirable
Le composant argon agit comme un bouclier protecteur.
Pendant que l'hydrogène effectue le travail de réduction sur l'étain, l'argon assure un environnement inerte pour le reste du matériau. Cela empêche le cœur de silicium de s'oxyder, ce qui dégraderait les performances du matériau.
Élimination précise des groupes fonctionnels
L'environnement du four permet l'élimination directionnelle des groupes contenant de l'oxygène.
En contrôlant la vitesse de chauffage et la durée de la température, le four garantit que les composants volatils quittent le matériau sans détruire la structure poreuse sous-jacente. Il en résulte une conversion "propre" du précurseur au matériau actif.
Comprendre les compromis
Bien que le four tubulaire permette cette synthèse complexe, le processus nécessite un équilibre délicat.
Sensibilité à la température La plage de 400 °C à 950 °C est large, mais la température spécifique choisie dicte les propriétés finales. Des températures plus basses peuvent entraîner une carbonisation incomplète (conductivité plus faible), tandis que des températures excessives pourraient entraîner un frittage ou une réaction indésirable du cœur de silicium.
Équilibre de l'atmosphère Le rapport hydrogène/argon est essentiel. Un manque d'hydrogène entraîne une réduction incomplète du SnO2 (laissant des oxydes résistifs). Inversement, un manque d'argon suffisant pourrait compromettre la protection inerte, permettant l'entrée d'oxygène.
Faire le bon choix pour votre objectif
Lors de l'optimisation de l'étape de carbonisation pour les composites Si@Sn@C, considérez votre objectif principal :
- Si votre objectif principal est la conductivité électrique : Assurez-vous que le débit d'hydrogène et la température sont suffisants pour réduire complètement le SnO2 en étain métallique (Sn) et pour graphitiser complètement la couche de brai.
- Si votre objectif principal est l'intégrité structurelle : Privilégiez le contrôle précis de la vitesse de chauffage pour éviter un dégazage rapide, ce qui préserve la couche de carbone amorphe et la structure poreuse du matériau.
Le four tubulaire est l'outil essentiel qui synchronise la réduction chimique de l'étain avec la formation structurelle du carbone, définissant la qualité finale de votre composite.
Tableau récapitulatif :
| Composant du processus | Fonction chimique/thermique | Transformation résultante |
|---|---|---|
| Débit d'hydrogène (H2) | Réduction chimique | Convertit le SnO2 en étain métallique (Sn) hautement conducteur |
| Atmosphère d'argon (Ar) | Blindage inerte | Prévient l'oxydation du silicium et assure une carbonisation stable |
| Chaleur (400°C - 950°C) | Déshydrogénation | Transforme le brai organique en une coque de carbone amorphe conductrice |
| Précision thermique | Contrôle structurel | Équilibre la préservation des pores avec la conversion complète du matériau |
Élevez votre synthèse de composites avec la précision KINTEK
Obtenir la structure ternaire Si@Sn@C parfaite nécessite un contrôle absolu de l'atmosphère et des gradients thermiques. KINTEK fournit des systèmes de fours tubulaires, sous vide et CVD de pointe, conçus pour les exigences rigoureuses de la recherche sur les matériaux de batteries avancés.
Pourquoi choisir KINTEK pour votre laboratoire ?
- R&D et fabrication expertes : Nos fours sont conçus pour un mélange précis de gaz (H2/Ar) et un chauffage uniforme jusqu'à 1800°C.
- Solutions personnalisables : Des tubes rotatifs pour le traitement uniforme des poudres aux systèmes CVD multi-zones, nous adaptons l'équipement à vos protocoles de synthèse uniques.
- Fiabilité inégalée : Assurez des résultats de carbonisation et de réduction reproductibles à chaque fois.
Prêt à optimiser les performances de vos matériaux ? Contactez nos experts techniques dès aujourd'hui pour trouver la solution haute température parfaite pour votre laboratoire.
Guide Visuel
Références
- Jinhuan Li, Haiyong He. Simple and Safe Synthesis of Yolk-Shell-Structured Silicon/Carbon Composites with Enhanced Electrochemical Properties. DOI: 10.3390/molecules29061301
Cet article est également basé sur des informations techniques de Kintek Furnace Base de Connaissances .
Produits associés
- 1700℃ Four tubulaire de laboratoire à haute température avec tube en quartz ou en alumine
- 1400℃ Four tubulaire de laboratoire à haute température avec tube en quartz et alumine
- 1200℃ Four à tube divisé Four à tube à quartz de laboratoire avec tube à quartz
- 1200℃ Four à atmosphère contrôlée d'azote inerte
- 1400℃ Four à moufle pour laboratoire
Les gens demandent aussi
- Quels aspects de conception d'un four tubulaire fendu influencent ses performances ? Optimisation de l'uniformité et de l'efficacité de la température
- Quels sont les avantages d'utiliser des fours horizontaux ? Augmenter l'efficacité et l'uniformité du traitement par lots
- Pourquoi un four tubulaire est-il préféré pour la synthèse de NRBBO:Eu2+ ? Obtenez un contrôle précis de l'atmosphère pour les luminophores
- Comment un four tubulaire à haute température forme-t-il du carbone poreux dopé à l'azote (RMF) ? Guide de synthèse thermique de précision
- Quel rôle joue un four tubulaire à haute température dans la carbonisation de la lignine ? Chauffage de précision pour le carbone poreux
- Pourquoi une atmosphère protégée par de l'azote dans un four tubulaire est-elle nécessaire pour le dopage au phosphore des matériaux carbonés ?
- Pourquoi les tubes de quartz scellés sous vide sont-ils essentiels pour les diagrammes de phase Bi-Sb-Te ? Assurez la fidélité chimique dans la synthèse de vos alliages
- Quel environnement de processus un four tubulaire offre-t-il pour la carbonisation des coquilles d'arachide ? Atteindre une porosité de haute qualité



















