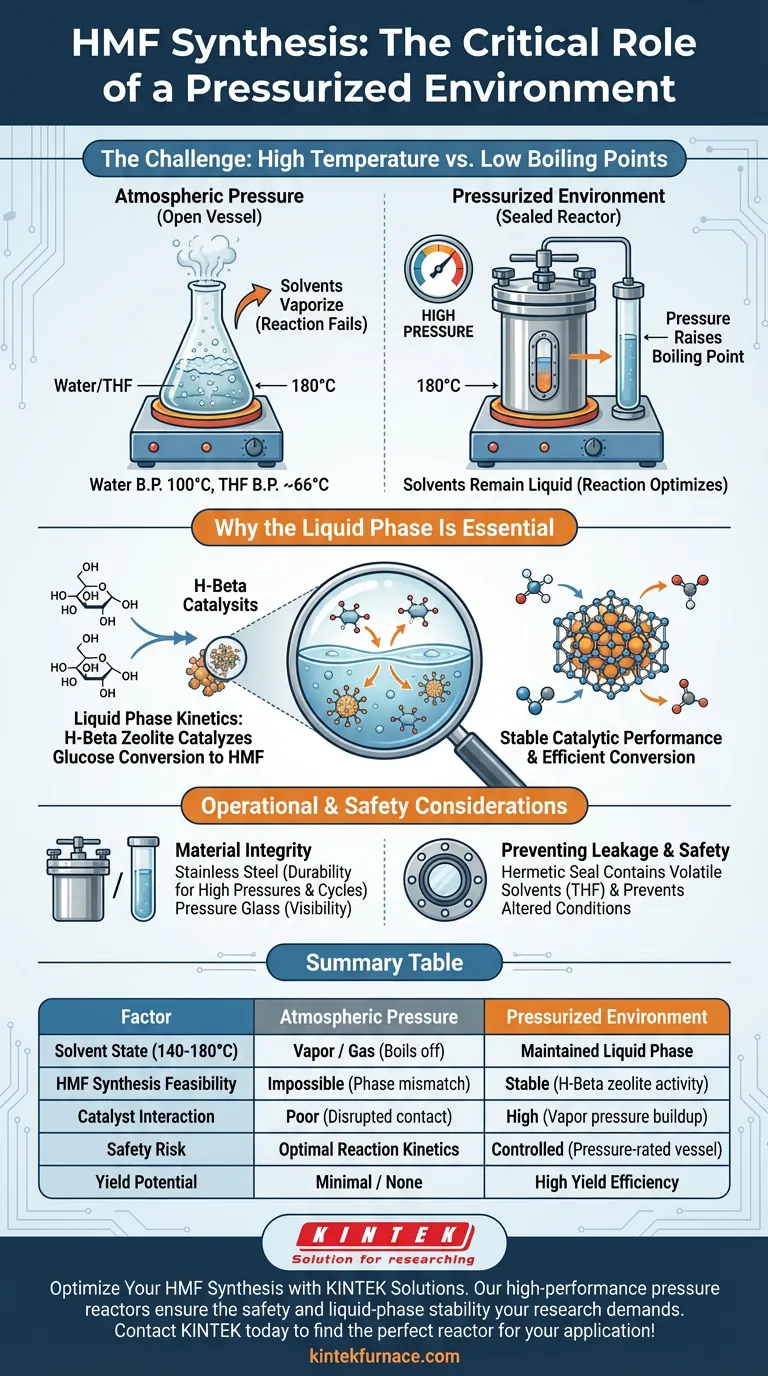
Un environnement sous pression est essentiel pour maintenir le système de solvant en phase liquide. Comme la synthèse du HMF se déroule généralement à des températures comprises entre 140°C et 180°C, la température de fonctionnement dépasse considérablement les points d'ébullition normaux des solvants utilisés, tels que l'eau et le tétrahydrofurane (THF). Sans récipient scellé et résistant à la pression, ces solvants se vaporiseraient immédiatement, empêchant la réaction de se produire.
En scellant le réacteur, vous augmentez artificiellement le point d'ébullition du mélange de solvants. Cela force l'eau et le THF à rester à l'état liquide malgré la chaleur élevée, créant ainsi l'environnement thermodynamique nécessaire pour que la zéolite H-Bêta catalyse la conversion du glucose.

Le rôle de la température et de la pression
Surmonter les points d'ébullition des solvants
La synthèse de l'hydroxyméthylfurfural (HMF) repose sur un système de solvants biphasique, généralement composé d'eau et de THF.
À pression atmosphérique normale, l'eau bout à 100°C et le THF bout à environ 66°C.
Atteindre la synthèse à haute température
Pour convertir efficacement le glucose en HMF à l'aide de la zéolite H-Bêta, la réaction nécessite des températures allant de 140°C à 180°C.
Comme cette plage est bien supérieure aux points d'ébullition des solvants, un récipient sous pression est le seul moyen de réaliser la réaction sans perdre le solvant par évaporation.
Stabilité thermodynamique et catalytique
Maintien de la cinétique en phase liquide
Pour que la conversion chimique se produise, les réactifs (glucose) doivent interagir avec le catalyseur (zéolite H-Bêta) dans un milieu liquide.
Les récipients résistants à la pression, tels que les autoclaves en acier inoxydable ou les tubes en verre à parois épaisses, confinent les vapeurs. Ce confinement génère une pression interne, maintenant le système de solvant en phase liquide nécessaire à la cinétique de la réaction.
Assurer la performance du catalyseur
La stabilité du processus catalytique est directement liée à la cohérence de l'environnement réactionnel.
La référence principale note qu'un environnement sous pression assure une performance catalytique stable. Si le solvant était autorisé à bouillir ou à fluctuer entre les phases, l'interaction entre la zéolite et le glucose serait perturbée, entraînant de faibles rendements ou une désactivation du catalyseur.
Considérations opérationnelles et sécurité
Intégrité des matériaux
Vous devez utiliser des réacteurs en acier inoxydable ou du verre spécial résistant à la pression.
La verrerie de laboratoire standard ne peut pas supporter la pression interne générée par le chauffage des solvants à 180°C. L'utilisation de matériaux inadéquats présente un risque important de rupture ou d'explosion du récipient.
Prévention des fuites de solvant
Au-delà du maintien de la pression, le récipient doit être hermétiquement scellé pour éviter les fuites physiques.
La perte de solvant pendant la réaction modifie la concentration des réactifs et peut rendre les conditions thermodynamiques instables. De plus, le confinement du THF (un solvant organique volatil) est essentiel pour la sécurité du laboratoire.
Application à votre configuration de réaction
Pour assurer une synthèse réussie du HMF, choisissez votre équipement en fonction des priorités suivantes :
- Si votre objectif principal est l'efficacité de la réaction : Assurez-vous que votre récipient est conçu pour des pressions nettement supérieures à la pression de vapeur de l'eau/THF à 180°C afin de garantir une phase liquide stable.
- Si votre objectif principal est la longévité de l'équipement : Choisissez l'acier inoxydable plutôt que le verre pour des cycles répétés à haute température afin de minimiser le risque de défaillance liée à la fatigue.
Le récipient sous pression n'est pas seulement un conteneur ; c'est un composant actif qui permet la thermodynamique requise pour la synthèse du HMF.
Tableau récapitulatif :
| Facteur | Pression atmosphérique | Environnement sous pression |
|---|---|---|
| État du solvant (140-180°C) | Vapeur / Gaz (S'évapore) | Phase liquide maintenue |
| Faisabilité de la synthèse du HMF | Impossible (Désaccord de phase) | Cinétique de réaction optimale |
| Interaction du catalyseur | Faible (Contact perturbé) | Stable (Activité de la zéolite H-Bêta) |
| Risque de sécurité | Élevé (Augmentation de la pression de vapeur) | Contrôlé (Récipient homologué pour la pression) |
| Potentiel de rendement | Minimal / Aucun | Efficacité de rendement élevée |
Optimisez votre synthèse de HMF avec les solutions KINTEK
Obtenez le contrôle thermodynamique précis requis pour la production d'hydroxyméthylfurfural (HMF) avec nos réacteurs sous pression haute performance. Soutenu par une R&D et une fabrication expertes, KINTEK propose une large gamme d'équipements de laboratoire, notamment des réacteurs en acier inoxydable, des tubes en verre résistant à la pression et des systèmes de fours haute température, tous personnalisables pour vos besoins spécifiques en laboratoire.
Que vous développiez la conversion du glucose ou que vous recherchiez la catalyse par zéolite H-Bêta, notre équipement garantit la sécurité, la durabilité et la stabilité de la phase liquide que votre recherche exige. Ne laissez pas l'évaporation du solvant compromettre vos résultats.
Contactez KINTEK dès aujourd'hui pour trouver le réacteur parfait pour votre application !
Guide Visuel
Références
- Xinyi Xing, Jianxiu Hao. H-Beta Zeolite as Catalyst for the Conversion of Carbohydrates into 5-Hydroxymethylfurfural: The Role of Calcination Temperature. DOI: 10.3390/catal14040248
Cet article est également basé sur des informations techniques de Kintek Furnace Base de Connaissances .
Produits associés
- Machine à four tubulaire CVD à zones de chauffage multiples pour équipement de dépôt chimique en phase vapeur
- 1700℃ Four tubulaire de laboratoire à haute température avec tube en quartz ou en alumine
- 1400℃ Four tubulaire de laboratoire à haute température avec tube en quartz et alumine
- Four tubulaire sous vide à haute pression pour laboratoire Four tubulaire à quartz
- Four tubulaire CVD à chambre divisée avec machine CVD à station de vide
Les gens demandent aussi
- Quel est le but de l'utilisation d'azote de haute pureté pour les expériences sur l'oxyde de zinc nanométrique ? Assurer la pureté et l'exactitude des données
- Quels sont les avantages du revêtement PVD ? Atteignez précision, pureté et performance écologique
- Quelle est la fonction principale d'une étuve sous vide pour les précurseurs de catalyseurs à base de Mo ? Assurer la pureté et l'intégrité des pores
- Qu'est-ce qu'un four industriel et quelles industries l'utilisent ? Découvrez des solutions de traitement thermique polyvalentes
- Quelle est l'importance de l'utilisation d'équipements de chauffage à haute température pour atteindre 1250°C pour les alliages ? Excellence des tests de résistance
- Pourquoi un contrôle précis des débits de gaz porteurs est-il requis pour l'activation de l'hydrochar ? Optimiser le rendement et la pureté du carbone
- Quelle fonction le gaz argon de haute pureté remplit-il dans la préparation PVT du BPEA ? Assurer une croissance cristalline de haute qualité
- Pourquoi un approvisionnement continu en argon de très haute pureté est-il nécessaire pour les alliages Aluminium-Silicium ? Assurer l'exactitude des données de viscosité



















