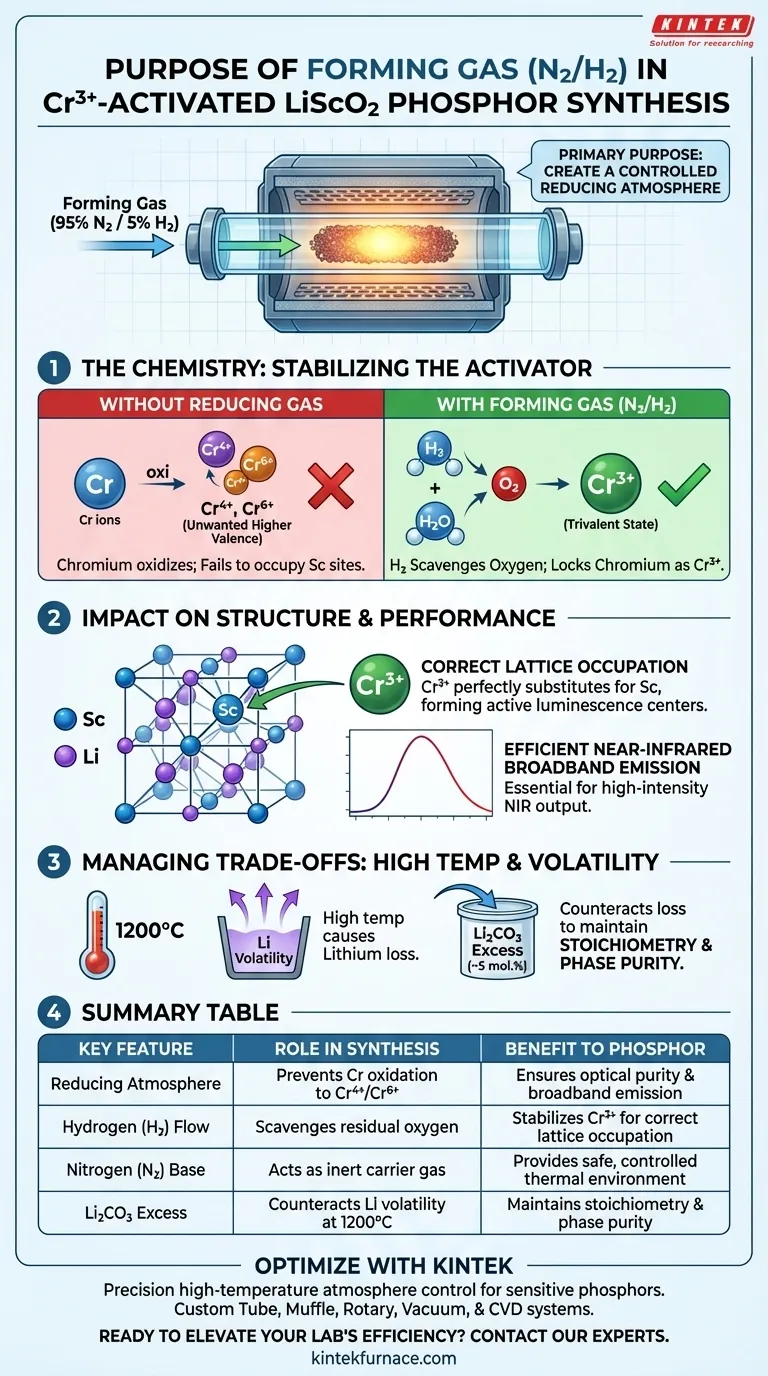
L'objectif principal de l'utilisation du gaz de formation (spécifiquement un mélange Azote/Hydrogène) est de créer une atmosphère réductrice contrôlée à l'intérieur du four tubulaire. Cet environnement est essentiel pour stabiliser chimiquement l'activateur de chrome pendant le traitement thermique à haute température, l'empêchant de réagir avec l'oxygène pour former des états de valence supérieurs indésirables.
Le gaz de formation agit comme un bouclier chimique, garantissant que le dopant de chrome reste dans l'état trivalent (Cr3+). Cet état de valence spécifique est le seul capable d'occuper correctement les sites de scandium dans le réseau, ce qui est la condition fondamentale pour obtenir une émission à large bande efficace dans le proche infrarouge.

La chimie de l'atmosphère réductrice
Prévention de l'oxydation indésirable
Lors de la synthèse à haute température, les métaux de transition comme le chrome sont très sensibles à l'oxydation.
Sans agent réducteur, le chrome s'oxyderait naturellement en états de valence supérieurs, spécifiquement en ions tétravalents (Cr4+) ou hexavalents (Cr6+).
Stabilisation de l'état trivalent
Le composant hydrogène (typiquement 5 %) du gaz de formation élimine activement l'oxygène résiduel.
Cette réaction maintient l'environnement réducteur, bloquant les atomes de chrome dans l'état trivalent critique (Cr3+) requis pour ce luminophore spécifique.
Impact sur la structure et les performances
Occupation correcte des sites du réseau
Pour que le luminophore LiScO2 fonctionne, l'activateur doit s'intégrer parfaitement dans la structure cristalline.
Étant donné que le Cr3+ a un rayon ionique et une charge spécifiques, il est chimiquement adapté pour substituer les ions scandium (Sc) dans le réseau hôte.
Si le chrome était autorisé à s'oxyder en Cr4+ ou Cr6+, cette substitution échouerait, entraînant des défauts de réseau plutôt que des centres de luminescence actifs.
Assurer l'efficacité optique
Les propriétés de luminescence du matériau sont directement liées à l'environnement électronique spécifique de l'ion Cr3+.
En maintenant l'état Cr3+ via le gaz de formation, vous assurez que le matériau crée une émission à large bande stable et de haute intensité dans le proche infrarouge.
Comprendre les compromis
Haute température vs. Volatilité du matériau
Bien que des températures élevées (environ 1200°C) soient nécessaires pour faciliter la substitution du Cr3+, elles introduisent des effets secondaires que le gaz seul ne peut pas corriger.
Plus précisément, le lithium est très volatil à ces températures et a tendance à s'évaporer du matériau.
Gestion de la stœchiométrie
L'atmosphère réductrice protège le chrome, mais elle n'empêche pas la perte de lithium.
Pour contrer cela, la synthèse nécessite l'ajout d'environ 5 % en moles d'excès de carbonate de lithium au mélange de départ.
Cette pré-compensation garantit que le produit final maintient le bon rapport stœchiométrique, évitant les phases secondaires qui pourraient dégrader la pureté protégée par le gaz de formation.
Faire le bon choix pour votre objectif
Pour obtenir des luminophores LiScO2:Cr3+ de haute qualité, vous devez équilibrer la protection chimique avec la compensation stœchiométrique.
- Si votre objectif principal est la pureté optique : Assurez un flux constant de gaz de formation (5 % H2) pour empêcher strictement la formation d'espèces Cr4+ ou Cr6+ qui tuent la luminescence.
- Si votre objectif principal est la pureté de phase : Combinez l'atmosphère réductrice avec un excès de 5 % en moles de carbonate de lithium pour compenser la volatilisation à 1200°C.
Maîtriser l'atmosphère contrôle la valence de l'activateur, tandis que maîtriser la stœchiométrie contrôle l'intégrité du réseau hôte.
Tableau récapitulatif :
| Caractéristique clé | Rôle dans la synthèse | Bénéfice pour le luminophore |
|---|---|---|
| Atmosphère réductrice | Empêche l'oxydation du chrome en Cr4+ ou Cr6+ | Assure la pureté optique et l'émission à large bande |
| Flux d'hydrogène (H2) | Élimine l'oxygène résiduel dans le four | Stabilise les ions Cr3+ pour une occupation correcte du réseau |
| Base d'azote (N2) | Agit comme un gaz porteur inerte | Fournit un environnement thermique sûr et contrôlé |
| Excès de Li2CO3 | Contrecarre la volatilité du lithium à 1200°C | Maintient la stœchiométrie et la pureté de phase |
Optimisez la synthèse de vos matériaux avec KINTEK
La précision est primordiale lors de la gestion des atmosphères à haute température pour les luminophores sensibles. Fort de R&D et de fabrication expertes, KINTEK propose des systèmes Tube, Muffle, Rotatif, sous Vide et CVD haute performance, tous entièrement personnalisables pour répondre à vos besoins de recherche uniques.
Que vous ayez besoin d'un contrôle précis du gaz de formation pour stabiliser les activateurs ou d'une uniformité thermique avancée pour gérer la volatilité des matériaux, nos fours de laboratoire offrent la fiabilité que vos innovations méritent.
Prêt à améliorer l'efficacité de votre laboratoire ? Contactez nos experts dès aujourd'hui pour trouver votre solution de four personnalisée !
Guide Visuel
Références
- Leoni Frehmeyer, Thomas Jüstel. On the optimisation of the broadband NIR emitter LiScO2:Cr3+. DOI: 10.6001/chemija.2025.36.2.5
Cet article est également basé sur des informations techniques de Kintek Furnace Base de Connaissances .
Produits associés
- 1700℃ Four tubulaire de laboratoire à haute température avec tube en quartz ou en alumine
- 1400℃ Four à atmosphère contrôlée d'azote inerte
- 1200℃ Four à atmosphère contrôlée d'azote inerte
- 1400℃ Four tubulaire de laboratoire à haute température avec tube en quartz et alumine
- 1200℃ Four à tube divisé Four à tube à quartz de laboratoire avec tube à quartz
Les gens demandent aussi
- Quelle est la signification de la zone de chauffage dans un four tubulaire vertical ? Débloquez la précision pour le traitement des matériaux
- Quelles sont les applications courantes des fours tubulaires de laboratoire en science des matériaux ? Débloquez la précision du traitement thermique et de la synthèse
- Comment un four tubulaire à haute température facilite-t-il la simulation de la combustion du charbon ? Maîtriser la R&D industrielle
- Quelles sont les applications courantes des fours tubulaires ? Débloquez la précision dans le traitement des matériaux
- Quels sont quelques exemples de modèles de fours tubulaires et leurs applications idéales ? Trouvez votre correspondance parfaite pour un traitement thermique précis
- Quelles sont les fonctions essentielles d'un four tubulaire haute température ? Maîtriser la pyrolyse composite TiN-Carbone
- Comment nettoyer un four tubulaire ? Un guide étape par étape pour un entretien sûr et efficace
- Quelle est la fonction principale d'un four tubulaire à haute température dans la préparation de Se@void@BLNC ? Synthèse Duale Maîtrisée



















