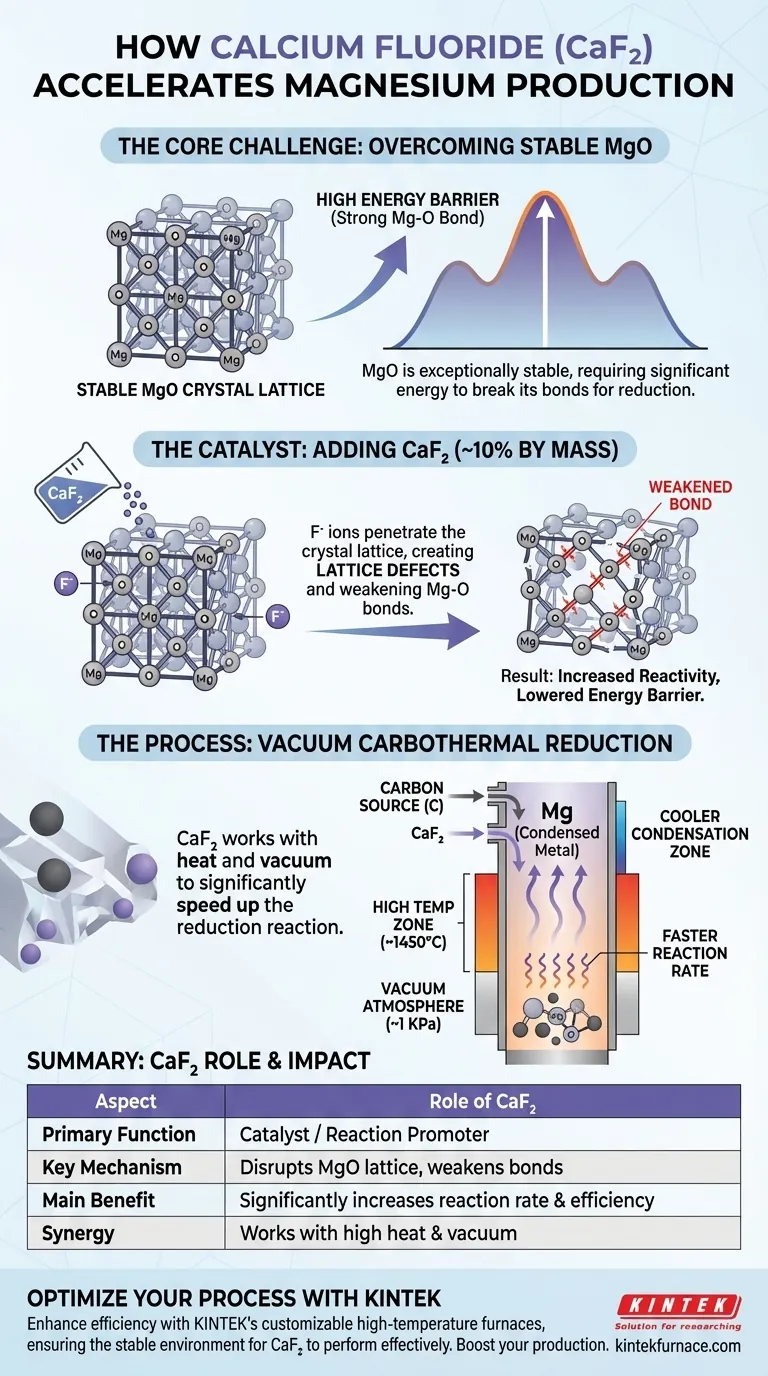
Dans la production de magnésium, l'ajout de fluorure de calcium (CaF2) remplit un objectif unique et essentiel : agir comme catalyseur ou promoteur de réaction. Il accélère considérablement la vitesse de la réaction de réduction carbothermique sous vide. Il y parvient en perturbant chimiquement la structure cristalline très stable de l'oxyde de magnésium (MgO), ce qui facilite la réduction.
Le principal défi de ce processus réside dans l'immense stabilité de la molécule d'oxyde de magnésium (MgO). Le fluorure de calcium est ajouté spécifiquement pour affaiblir les liaisons chimiques au sein du réseau cristallin du MgO, abaissant ainsi l'énergie nécessaire à la réaction et améliorant considérablement la vitesse et l'efficacité globales de la production de magnésium.

Le défi principal : surmonter la stabilité du MgO
Un composé très stable
L'oxyde de magnésium est un matériau céramique exceptionnellement stable avec un réseau cristallin solide et compact. La liaison entre le magnésium et l'oxygène (Mg-O) est puissante et nécessite une quantité d'énergie considérable pour être rompue.
La barrière énergétique
Cette stabilité intrinsèque crée une barrière énergétique élevée pour le processus de réduction carbothermique. Bien que les températures élevées et les conditions de vide nécessaires soient utiles, la réaction resterait d'une lenteur peu pratique sans un moyen d'abaisser cette barrière.
Comment le fluorure de calcium accélère la réaction
Le mécanisme : perturbation du réseau
Lorsqu'il est ajouté aux matières premières, généralement environ 10 % en masse, le fluorure de calcium introduit des ions fluorure (F-). Ces ions pénètrent dans le réseau cristallin de l'oxyde de magnésium.
Cette infiltration crée des défauts de réseau — des imperfections et des points de faiblesse — au sein de la structure MgO, par ailleurs uniforme et stable.
L'impact : réactivité accrue
Ces défauts déstabilisent le cristal et affaiblissent efficacement les liaisons Mg-O environnantes. Avec sa structure compromise, l'oxyde de magnésium devient considérablement plus réactif chimiquement.
Le résultat : des vitesses de réduction plus rapides
Étant donné que les liaisons Mg-O sont plus faciles à rompre, la réaction de réduction avec le carbone se déroule beaucoup plus rapidement et à une température effective plus basse. Cela conduit à un taux de réduction final plus élevé et à une conversion plus efficace du MgO en vapeur de magnésium.
Le rôle de l'environnement du processus
Le besoin de chaleur et de vide
Cette accélération chimique fonctionne en tandem avec l'environnement physique. Un four tubulaire vertical fournit les températures élevées (par exemple, 1723 K ou 1450 °C) nécessaires pour fournir l'énergie de la réaction.
Simultanément, une atmosphère de vide poussé (par exemple, 1 KPa) est maintenue. Le vide abaisse le point d'ébullition du magnésium, lui permettant de se transformer en vapeur à une température plus basse et d'être facilement éliminé, ce qui contribue à faire avancer la réaction et permet d'économiser considérablement de l'énergie.
Faciliter la collecte
La vapeur de magnésium monte ensuite et se condense dans une zone plus froide du four. La conception du four vertical aide à créer un gradient de température qui facilite cette migration directionnelle pour une collecte efficace.
Comprendre les compromis
Considérations sur la pureté
L'introduction de tout additif, y compris le CaF2, crée un potentiel de contamination du produit final. Le contrôle du processus doit être précis pour minimiser le transfert de composés fluorés dans le magnésium condensé.
Coût vs Bénéfice
Le coût de l'additif CaF2 et sa manipulation doivent être pris en compte dans l'économie globale du processus. Cependant, l'augmentation spectaculaire de la vitesse de réaction et les économies d'énergie qui en résultent dépassent largement ce coût, faisant de son utilisation une pratique industrielle standard.
Comment appliquer cela à votre processus
Voici les points clés basés sur votre objectif principal :
- Si votre objectif principal est de maximiser la vitesse de réaction : L'ajout de CaF2 est le levier le plus efficace, car il cible directement l'étape limitante de la rupture de la liaison Mg-O tenace.
- Si votre objectif principal est l'efficacité énergétique : Le CaF2 fonctionne en synergie avec l'environnement sous vide, permettant des réactions plus rapides à des températures effectives plus basses, ce qui réduit la consommation globale d'énergie par unité de magnésium produit.
- Si votre objectif principal est la pureté du produit : Bien que le CaF2 soit essentiel pour la cinétique, vous devez valider que les étapes de raffinage et de condensation ultérieures sont suffisantes pour éliminer toute impureté potentielle à base de fluorure.
En fin de compte, l'utilisation du fluorure de calcium est une intervention chimique stratégique qui transforme la réduction carbothermique du magnésium d'un processus lent et à forte consommation d'énergie en une réalité industrielle efficace.
Tableau récapitulatif :
| Aspect | Rôle du fluorure de calcium (CaF2) |
|---|---|
| Fonction principale | Agit comme catalyseur/promoteur de réaction |
| Mécanisme clé | Perturbe le réseau cristallin du MgO, affaiblissant les liaisons Mg-O |
| Bénéfice principal | Augmente considérablement la vitesse et l'efficacité de la réaction |
| Utilisation typique | ~10 % en masse des matières premières |
| Synergie | Fonctionne avec la haute température et le vide pour réduire les coûts énergétiques |
Optimisez vos processus métallurgiques à haute température avec KINTEK
Vous cherchez à améliorer l'efficacité et le rendement de votre production de métaux, comme le magnésium par réduction carbothermique ? La bonne technologie de four est essentielle pour maintenir les conditions précises de haute température et de vide requises.
Fort de son expertise en R&D et en fabrication, KINTEK propose des systèmes Muffle, Tube, Rotatif, sous Vide et CVD, ainsi que d'autres fours de laboratoire à haute température, tous personnalisables pour des besoins uniques. Notre équipement robuste et fiable garantit l'environnement stable nécessaire aux additifs catalytiques comme le CaF2 pour fonctionner efficacement, vous aidant à obtenir des temps de réaction plus rapides et une consommation d'énergie réduite.
Prêt à améliorer l'efficacité de votre production ? Contactez nos experts dès aujourd'hui pour discuter d'une solution de four adaptée à vos défis de processus spécifiques.
Guide Visuel
Produits associés
- Four à moufle de laboratoire avec levage par le bas
- 1700℃ Four à atmosphère contrôlée d'azote inerte
- Four de traitement thermique sous vide avec revêtement en fibre céramique
- Four tubulaire sous vide à haute pression pour laboratoire Four tubulaire à quartz
- Four à moufle à haute température pour le déliantage et le pré-frittage en laboratoire
Les gens demandent aussi
- Quel est le rôle d'un four à moufle dans la synthèse du Sr3Al2O6 soluble dans l'eau ? Précision dans la production de SAO
- Quel rôle le four à moufle joue-t-il dans la préparation des matériaux de support de MgO ? Activation du catalyseur maître
- Quelles sont les conditions environnementales critiques pour la céramisation du SiOC ? Maîtriser l'oxydation précise et le contrôle thermique
- Pourquoi un four à moufle haute performance est-il nécessaire pour la calcination des nanopoudres ? Obtenir des nanocristaux purs
- Quelles substances sont interdites dans la chambre du four ? Prévenir les défaillances catastrophiques



















