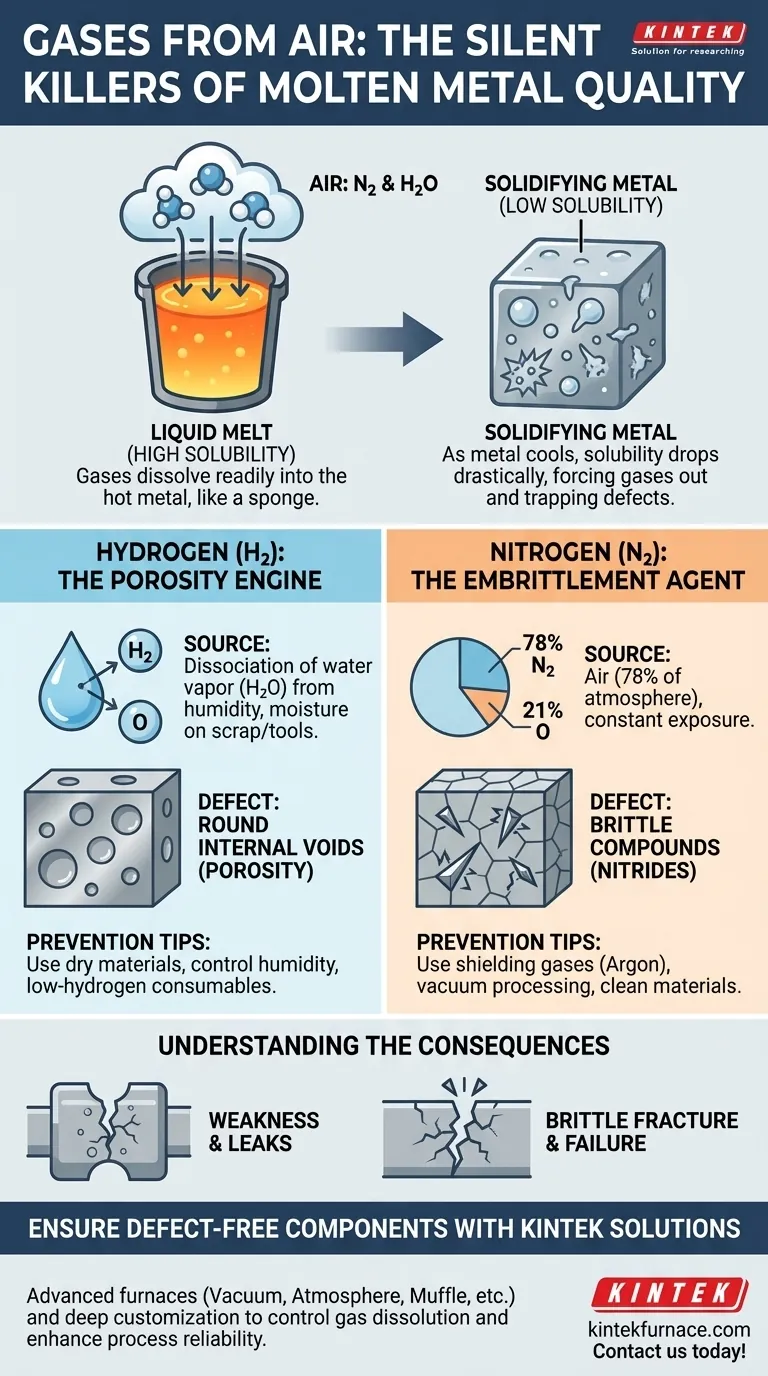
Les deux gaz présents dans l'air qui causent les défauts les plus importants dans le métal en fusion sont l'azote et l'hydrogène. Aux températures élevées d'un bain liquide, ces gaz se dissolvent facilement dans le métal, mais à mesure qu'il refroidit et se solidifie, leur solubilité chute drastiquement, les forçant à sortir de la solution et créant des défauts internes dommageables.
Le métal en fusion agit comme une éponge pour l'hydrogène et l'azote. Lorsque le métal se solidifie, il ne peut plus contenir ces gaz dissous, qui se retrouvent alors piégés sous forme de bulles (porosité) ou forment des composés cassants qui compromettent l'intégrité du produit final.

Le principe fondamental : la solubilité des gaz dans le métal
Le problème fondamental est une loi physique : les gaz sont nettement plus solubles dans le métal liquide que dans le métal solide. Cette différence de solubilité est le moteur de la formation des défauts pendant le processus de coulée ou de soudage.
Imaginez cela comme dissoudre du sucre dans l'eau. Vous pouvez dissoudre beaucoup plus de sucre dans de l'eau chaude que dans de l'eau froide. Si vous refroidissez une solution chaude de sucre saturée, le sucre précipitera sous forme de cristaux. Le métal en fusion et les gaz dissous se comportent de manière très similaire.
Le problème des hautes températures
Aux températures de fusion, les atomes du métal sont faiblement agencés et possèdent une énergie élevée, laissant plus d'espace pour que les petits atomes de gaz comme l'hydrogène et l'azote diffusent dans le liquide. L'atmosphère environnante fournit un apport quasi illimité de ces gaz.
La phase critique de refroidissement
Lorsque le métal refroidit et commence à se solidifier, sa structure cristalline devient plus rigide et ordonnée. Il n'y a tout simplement plus de place pour les atomes de gaz dissous. Cette chute soudaine de solubilité force le gaz à quitter la matrice métallique. Étant donné que l'extérieur de la coulée ou de la soudure se solidifie en premier, ce gaz qui s'échappe se retrouve piégé à l'intérieur du métal en cours de solidification.
Les deux coupables principaux provenant de l'air
Bien que l'air soit un mélange de gaz, l'azote et l'hydrogène sont les plus problématiques en raison de leur taille atomique, de leur réactivité et de leur abondance.
L'hydrogène (H) : le moteur de la porosité
L'hydrogène est le plus petit atome et peut facilement diffuser dans le métal en fusion. La source principale n'est généralement pas l'hydrogène gazeux, mais la dissociation de la vapeur d'eau (H₂O) provenant de l'humidité de l'air ou de l'humidité présente sur les ferrailles, les outils ou les flux.
À haute température, l'eau se décompose, libérant de l'hydrogène qui est absorbé par le bain de fusion. Lors du refroidissement, cet hydrogène est agressivement rejeté par le métal en solidification, formant des vides internes ronds connus sous le nom de porosité à l'hydrogène.
L'azote (N₂) : l'agent de fragilisation
L'azote constitue environ 78 % de l'air, ce qui garantit une exposition constante. Comme l'hydrogène, il peut provoquer de la porosité, mais son effet plus insidieux est sa capacité à réagir avec le métal de base et les éléments d'alliage.
Dans les métaux comme l'acier, l'aluminium, et surtout le titane, l'azote dissous peut former des composés durs et cassants appelés nitrures lors du refroidissement. Ces nitrures agissent comme des points de contrainte internes, réduisant considérablement la ductilité et la ténacité du matériau, un phénomène connu sous le nom de fragilisation.
Comprendre les conséquences
Les défauts causés par les gaz dissous ne sont pas seulement esthétiques ; ils ont un impact direct sur la performance mécanique et la fiabilité du composant final.
La porosité : l'effet « gruyère »
La porosité gazeuse crée un réseau de vides internes. Cela réduit la section transversale du composant, le rendant plus faible et moins dense. Ces vides lisses et sphériques agissent également comme des concentrateurs de contraintes, offrant un point d'initiation facile pour la formation et la croissance des fissures sous charge, conduisant à une défaillance prématurée.
La fragilisation : nitrures et hydrures
Contrairement aux vides, les nitrures (et moins couramment, les hydrures) sont des particules physiques intégrées dans la structure cristalline du métal. Ces inclusions dures, semblables à de la céramique, perturbent la continuité du réseau métallique.
Elles empêchent le métal de se déformer plastiquement sous contrainte, le faisant se fracturer de manière fragile avec peu ou pas d'avertissement. Ceci est particulièrement dangereux dans les applications nécessitant de la ténacité et une résistance aux chocs.
Faire le bon choix pour votre processus
Le contrôle de l'atmosphère et des matières premières n'est pas une étape facultative ; il est fondamental pour produire des composants métalliques sains. Votre objectif principal dépendra du mode de défaillance que vous devez prévenir.
- Si votre objectif principal est de prévenir la faiblesse structurelle et les fuites : Votre but est de minimiser l'absorption d'hydrogène pour réduire la porosité. Cela signifie s'assurer que tous les matériaux sont secs et contrôler l'humidité.
- Si votre objectif principal est d'assurer la ductilité et la résistance aux chocs : Vous devez contrôler l'exposition à l'azote, en particulier dans les alliages sensibles. Cela peut nécessiter l'utilisation de gaz de protection (comme l'argon) ou de processus sous vide.
- Si votre objectif principal est la qualité globale dans les alliages haute performance : Vous devez contrôler agressivement l'hydrogène et l'azote grâce à une combinaison de matières premières propres, de protection sous vide ou sous gaz inerte, et de traitements de bain spécifiques.
En fin de compte, maîtriser l'interaction entre l'atmosphère et le bain de fusion est essentiel pour transformer une bonne conception en un produit fiable et haute performance.
Tableau récapitulatif :
| Gaz | Source principale | Principaux défauts causés | Conseils de prévention |
|---|---|---|---|
| Hydrogène | Vapeur d'eau, humidité | Porosité (vides) | Utiliser des matériaux secs, contrôler l'humidité |
| Azote | Air (78 % de l'atmosphère) | Fragilisation (nitrures) | Utiliser des gaz de protection, processus sous vide |
Assurez-vous que vos composants métalliques sont exempts de défauts grâce aux solutions de fours avancées de KINTEK ! Tirant parti d'une R&D exceptionnelle et d'une fabrication interne, nous fournissons divers laboratoires équipés de fours à haute température tels que les fours à moufle, tubulaires, rotatifs, sous vide et à atmosphère contrôlée, ainsi que des systèmes CVD/PECVD. Notre capacité de personnalisation approfondie répond précisément à vos besoins expérimentaux uniques pour contrôler la dissolution des gaz et prévenir les défauts. Contactez-nous dès aujourd'hui pour améliorer la fiabilité de votre processus et la qualité de vos produits !
Guide Visuel
Produits associés
- 1700℃ Four à atmosphère contrôlée d'azote inerte
- 1400℃ Four à atmosphère contrôlée d'azote inerte
- Four de fusion à induction sous vide et four de fusion à arc
- 1200℃ Four à atmosphère contrôlée d'azote inerte
- Four de frittage sous vide à traitement thermique avec pression pour le frittage sous vide
Les gens demandent aussi
- Comment l'argon et l'azote protègent-ils les échantillons dans les fours sous vide ? Optimisez votre processus thermique avec le bon gaz
- À quoi sert la technologie des gaz inertes dans les fours à vide à atmosphère haute température ? Protéger les matériaux et accélérer le refroidissement
- Quels sont les principaux gaz inertes utilisés dans les fours sous vide ? Optimisez votre processus de traitement thermique
- Comment un système de contrôle de débit de gaz mixte maintient-il la stabilité lors de la nitruration à haute température ? Rapports de gaz de précision
- Quelles sont les perspectives de développement des fours à boîte à atmosphère contrôlée dans l'industrie aérospatiale ? Débloquez le traitement avancé des matériaux pour l'innovation aérospatiale



















