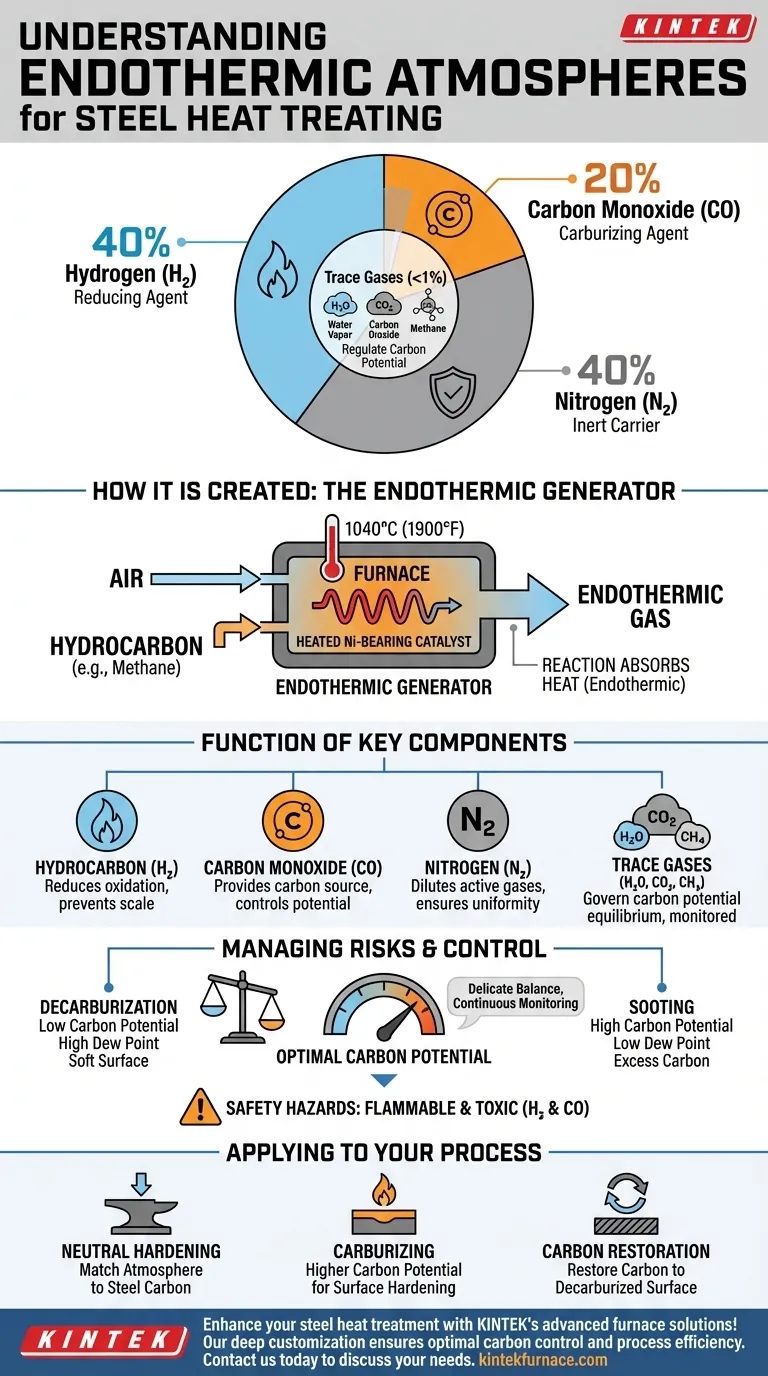
Dans sa forme la plus basique, une atmosphère endothermique typique est un mélange gazeux précisément conçu utilisé pour protéger l'acier pendant le traitement thermique à haute température. La composition nominale est d'environ 40 % d'hydrogène (H₂), 20 % de monoxyde de carbone (CO) et **40 % d'azote (N₂) **, avec de très petites quantités contrôlées de vapeur d'eau (H₂O), de dioxyde de carbone (CO₂) et de méthane (CH₄).
Le véritable objectif d'une atmosphère endothermique n'est pas seulement d'être un écran protecteur, mais de créer un environnement chimiquement actif. Elle est conçue pour être en équilibre avec la teneur en carbone de l'acier, empêchant à la fois la perte et le gain indésirable de carbone à la surface.

Comment est créée une atmosphère endothermique
La composition spécifique d'une atmosphère endothermique est le résultat direct de la manière dont elle est générée. Elle n'est pas créée en mélangeant simplement des gaz en bouteille.
La réaction du générateur
Le gaz est produit dans un appareil appelé générateur endothermique. À l'intérieur, un rapport contrôlé d'air et d'un gaz hydrocarboné (généralement du gaz naturel, qui est principalement du méthane) est mis à réagir à haute température (environ 1040 °C ou 1900 °F).
Le rôle du catalyseur
Cette réaction se produit sur un catalyseur contenant du nickel chauffé. Le catalyseur facilite la décomposition et la reformation des molécules dans la composition atmosphérique souhaitée.
Pourquoi « endothermique »
Le processus est appelé « endothermique » car la réaction chimique absorbe de la chaleur de son environnement pour se produire. C'est pourquoi le générateur doit être chauffé en continu pour maintenir la réaction et produire un mélange gazeux stable.
La fonction de chaque composant gazeux
Chaque composant de l'atmosphère joue un rôle distinct et critique dans le processus de traitement thermique. Comprendre ces rôles est essentiel pour contrôler le résultat pour vos pièces en acier.
Hydrogène (H₂) - L'agent réducteur
L'hydrogène est un puissant agent réducteur. Sa tâche principale est de rechercher et de réagir avec tout oxygène présent dans le four. Cela empêche la formation d'oxyde de fer (calamine) sur la surface de l'acier, le gardant propre et brillant.
Monoxyde de carbone (CO) - Le porteur de carbone
Le monoxyde de carbone est le principal gaz de carburation actif. Il est la source de carbone qui peut être transférée à l'acier. La concentration de CO, en équilibre avec les autres gaz, détermine le « potentiel de carbone » de l'atmosphère.
Azote (N₂) - Le porteur inerte
L'azote est largement inerte aux températures de trempe typiques. Il fonctionne comme un gaz porteur, diluant les composants actifs (H₂ et CO) et les transportant dans tout le four pour assurer un environnement homogène autour des pièces.
Les gaz traces critiques (H₂O, CO₂, CH₄)
Bien que présents en petites quantités (souvent <1 %), ces gaz sont cruciaux. L'équilibre entre CO/CO₂ et H₂/H₂O est ce qui régit finalement le potentiel de carbone. Ces quantités traces sont continuellement surveillées via des analyseurs de point de rosée ou des sondes à oxygène pour contrôler précisément si l'atmosphère ajoute, retire ou maintient le carbone sur la surface de l'acier.
Comprendre les compromis et les risques
Un gaz endothermique mal contrôlé est l'une des sources les plus courantes de défauts de traitement thermique. L'équilibre est délicat et nécessite une surveillance constante.
Le risque de décarburation
Si le potentiel de carbone de l'atmosphère est trop faible pour l'acier traité (souvent indiqué par un point de rosée élevé ou un taux élevé de CO₂), il aspirera activement le carbone hors de la surface de l'acier. Cela crée une couche superficielle douce et faible connue sous le nom de décarburation, qui peut entraîner la rupture de la pièce.
Le risque d'encrassement (suie)
Inversement, si le potentiel de carbone est trop élevé (indiqué par un point de rosée faible ou un taux élevé de CH₄), l'atmosphère déposera un excès de carbone sous forme de suie sur les pièces et l'intérieur du four. Cela crée des défis de nettoyage importants et peut interférer avec le processus.
Dangers de sécurité critiques
Il est essentiel de reconnaître que cette atmosphère est à la fois inflammable et toxique. L'hydrogène est hautement explosif lorsqu'il est mélangé à l'air, et le monoxyde de carbone est un poison mortel. Un entretien approprié du four, une ventilation et des protocoles de sécurité sont non négociables.
Application à votre processus
Votre objectif dicte la manière dont vous contrôlez l'atmosphère. La composition « nominale » n'est qu'un point de départ ; le contrôle réel vient de l'ajustement du rapport air/gaz pour affiner les éléments traces.
- Si votre objectif principal est le durcissement neutre : Vous devez faire correspondre précisément le potentiel de carbone de l'atmosphère à la teneur en carbone de l'alliage d'acier pour ne ni ajouter ni retirer de carbone.
- Si votre objectif principal est la carburation : Vous fonctionnerez avec un potentiel de carbone plus élevé pour diffuser intentionnellement du carbone à la surface d'un acier à faible teneur en carbone, créant un cœur dur et résistant à l'usure.
- Si votre objectif principal est la restauration du carbone : Vous réglerez un potentiel de carbone pour correspondre au niveau de carbone du cœur de l'acier, permettant au carbone de diffuser à nouveau dans une couche superficielle précédemment décarburée.
En fin de compte, maîtriser une atmosphère endothermique revient à atteindre un équilibre chimique précis entre le gaz et l'acier.
Tableau récapitulatif :
| Composant | Pourcentage typique | Fonction clé |
|---|---|---|
| Hydrogène (H₂) | 40 % | Agit comme agent réducteur pour prévenir l'oxydation et la formation de calamine sur les surfaces d'acier. |
| Monoxyde de carbone (CO) | 20 % | Sert d'agent de carburation primaire, transférant le carbone à l'acier pour contrôler le potentiel de carbone. |
| Azote (N₂) | 40 % | Fonctionne comme gaz porteur inerte, diluant les composants actifs pour une distribution uniforme dans le four. |
| Gaz traces (H₂O, CO₂, CH₄) | <1 % | Régulent le potentiel de carbone par l'équilibre ; surveillés pour un contrôle précis afin de prévenir les défauts tels que la décarburation ou l'encrassement. |
Améliorez votre traitement thermique de l'acier avec les solutions de fours avancées de KINTEK ! Forts d'une R&D exceptionnelle et d'une fabrication interne, nous fournissons à divers laboratoires des fours à haute température tels que des fours à moufle, à tube, rotatifs, sous vide et à atmosphère, ainsi que des systèmes CVD/PECVD. Notre solide capacité de personnalisation approfondie garantit que nous répondons précisément à vos besoins expérimentaux uniques, vous aidant à atteindre un contrôle optimal du carbone et une efficacité de processus. Contactez-nous dès aujourd'hui pour discuter de la manière dont nos solutions sur mesure peuvent bénéficier à vos opérations !
Guide Visuel
Produits associés
- 1700℃ Four à atmosphère contrôlée d'azote inerte
- 1400℃ Four à atmosphère contrôlée d'azote inerte
- Four à atmosphère contrôlée à bande maillée Four à atmosphère inerte à l'azote
- 1200℃ Four à atmosphère contrôlée d'azote inerte
- Four à atmosphère inerte contrôlée d'azote et d'hydrogène
Les gens demandent aussi
- À quoi sert la technologie des gaz inertes dans les fours à vide à atmosphère haute température ? Protéger les matériaux et accélérer le refroidissement
- Quelles sont les applications spécifiques des fours à atmosphère contrôlée dans l'industrie de la céramique ? Améliorer la pureté et la performance
- Les fours à résistance haute température de type boîte peuvent-ils contrôler l'atmosphère ? Débloquez la précision dans le traitement des matériaux
- Comment l'argon et l'azote protègent-ils les échantillons dans les fours sous vide ? Optimisez votre processus thermique avec le bon gaz
- Quelles sont les caractéristiques clés d'un four boîte à atmosphère contrôlée ? Débloquez un traitement thermique précis dans des environnements contrôlés



















