L'argon est le gaz inerte le plus couramment utilisé dans les boîtes à gants et les lignes Schlenk pour les expériences très sensibles. Bien que l'azote soit une alternative moins chère et plus fréquente, l'argon est strictement préféré lorsqu'il existe un risque que le gaz « inerte » réagisse avec les matériaux expérimentaux, ce qui peut se produire avec certains métaux ou à des températures élevées.
Le choix entre l'argon et l'azote est une décision critique en chimie sensible à l'air, équilibrant le coût et la pureté chimique. Bien que l'azote soit un cheval de bataille rentable, l'argon offre un niveau d'inertie supérieur, agissant comme une assurance essentielle pour les expériences très réactives ou à haute température.

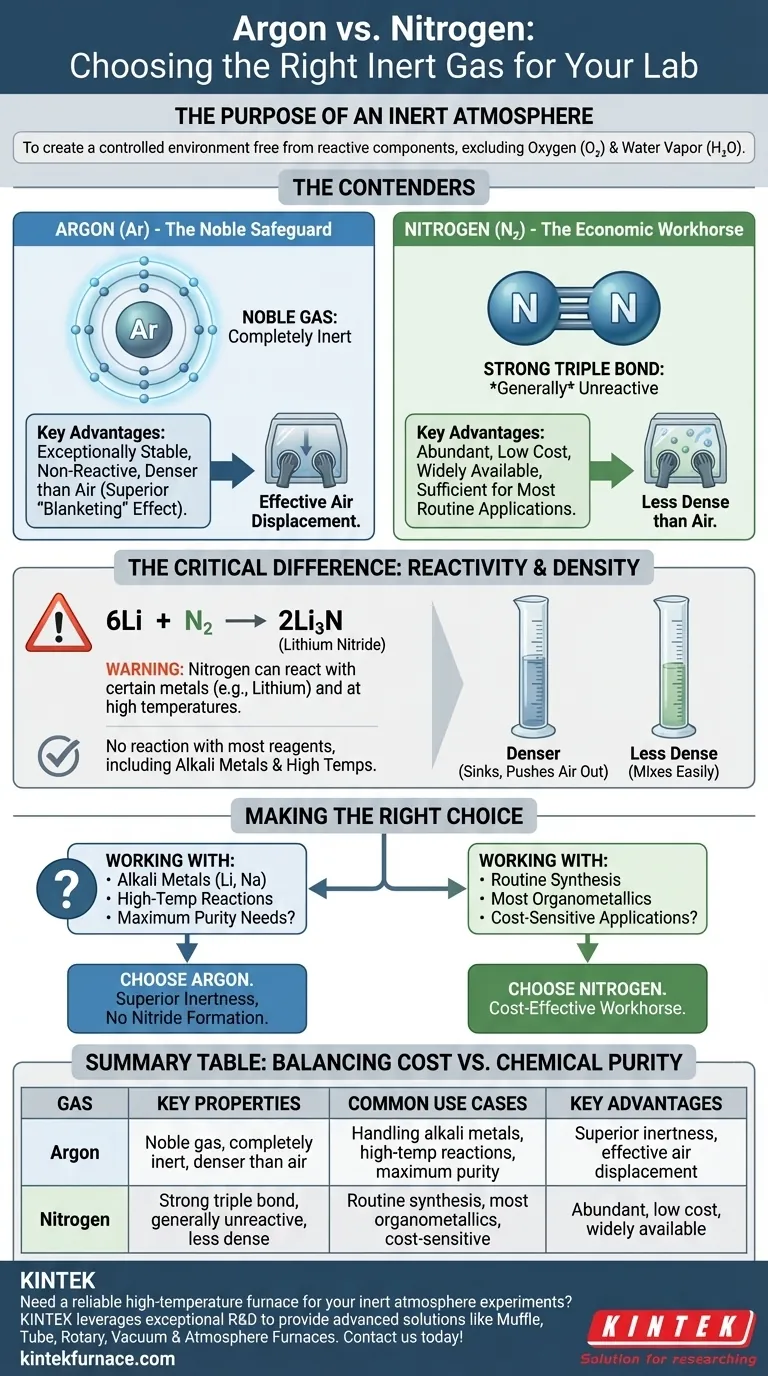
Le rôle d'une atmosphère inerte
La fonction principale d'une boîte à gants ou d'une ligne Schlenk est de créer un environnement contrôlé exempt de composants atmosphériques réactifs. Les principaux coupables que vous essayez d'exclure sont l'oxygène (O₂) et la vapeur d'eau (H₂O), qui peuvent facilement décomposer les réactifs et les catalyseurs sensibles.
Un gaz inerte, tel que l'argon ou l'azote, est utilisé pour déplacer l'air et maintenir une pression positive, empêchant toute fuite atmosphérique dans le système.
Comparaison des concurrents : Argon contre Azote
Bien que les deux soient utilisés pour créer une atmosphère inerte, leurs propriétés chimiques et physiques dictent quand l'un est un meilleur choix que l'autre.
L'azote : Le cheval de bataille économique
L'azote (N₂) représente environ 78 % de l'air que nous respirons et est donc abondant et peu coûteux.
La molécule de N₂ est caractérisée par une très forte liaison triple entre ses deux atomes d'azote. Cette liaison nécessite une quantité importante d'énergie pour être rompue, c'est pourquoi l'azote est généralement non réactif et adapté à un large éventail d'applications chimiques.
L'argon : La sauvegarde noble
L'argon (Ar) est un gaz noble. Cela signifie que ses atomes possèdent une couche d'électrons externe complète, ce qui le rend exceptionnellement stable et non réactif.
Dans pratiquement toutes les conditions de laboratoire, l'argon ne formera pas de liaisons chimiques ni ne réagira avec vos réactifs. Cette inertie chimique fondamentale est sa plus grande force.
La différence critique : La réactivité
Le terme « inerte » est relatif. Bien que l'azote soit majoritairement non réactif, il n'est pas complètement inerte.
Dans des conditions spécifiques, l'azote peut réagir avec certains métaux pour former des nitrures métalliques. L'exemple le plus courant en chimie synthétique implique le lithium métallique, qui réagit facilement avec le gaz N₂ même à température ambiante pour former du nitrure de lithium (Li₃N).
6Li + N₂ → 2Li₃N
Cette réaction secondaire indésirable peut consommer votre réactif et introduire des impuretés. Des réactions similaires peuvent se produire avec d'autres métaux alcalins, des métaux alcalino-terreux ou lors de synthèses menées à haute température. L'argon, en tant que gaz noble, n'a pas cette contrainte.
Une considération pratique : La densité du gaz
Une différence physique clé est la densité. L'argon est environ 40 % plus dense que l'air, tandis que l'azote est légèrement moins dense que l'air.
Cela signifie que l'argon est plus efficace pour déplacer l'air d'un récipient, car il « plonge » et pousse l'air plus léger vers le haut et vers l'extérieur. Cet effet de « couverture » le rend supérieur pour le purgage de la verrerie sur une ligne Schlenk et le maintien d'une atmosphère stable à l'intérieur d'une boîte à gants, car il se dépose au fond au lieu de se mélanger facilement.
Comprendre les compromis
Choisir le bon gaz nécessite d'équilibrer la sécurité absolue avec les contraintes pratiques.
Coût : Le moteur principal
L'avantage le plus significatif de l'azote est son faible coût. L'argon est nettement plus cher que l'azote.
Pour les laboratoires gérant de nombreuses boîtes à gants ou effectuant de la synthèse à grande échelle, cette différence de coût peut être un facteur majeur. Pour cette raison, l'azote est souvent le choix par défaut pour tout travail où sa réactivité potentielle n'est pas une préoccupation.
Pureté et approvisionnement
Les deux gaz sont commercialement disponibles en qualités de très haute pureté (par exemple, 99,999 %). La différence clé réside souvent dans la méthode d'approvisionnement.
Les utilisateurs d'azote à grande échelle peuvent disposer de générateurs sur site ou de grands réservoirs d'azote liquide qui assurent un approvisionnement continu en gaz par évaporation, réduisant ainsi davantage son coût opérationnel. L'argon est presque toujours fourni en bouteilles de gaz haute pression, qui nécessitent un remplacement régulier.
Faire le bon choix pour votre expérience
Votre décision doit être basée sur la chimie spécifique que vous effectuez.
- Si votre objectif principal est la synthèse de routine, la purification ou la manipulation de la plupart des organométalliques : Utilisez l'azote. Il est suffisamment inerte pour la grande majorité des applications et offre des économies de coûts significatives.
- Si votre objectif principal est de travailler avec du lithium, d'autres métaux alcalins ou d'effectuer des réactions à haute température : Utilisez l'argon. Son inertie supérieure n'est pas négociable et protège votre expérience de la formation de nitrures métalliques indésirables.
- Si votre objectif principal est une certitude maximale et l'élimination de toutes les variables : Utilisez l'argon. Le coût plus élevé est un faible prix à payer pour l'assurance que votre gaz inerte est vraiment inerte.
En fin de compte, comprendre la réactivité subtile de l'azote est ce qui sépare la pratique courante d'une conception expérimentale précise et délibérée.
Tableau récapitulatif :
| Gaz | Propriétés clés | Cas d'utilisation courants | Avantages clés |
|---|---|---|---|
| Argon | Gaz noble, complètement inerte, plus dense que l'air | Manipulation de métaux alcalins, réactions à haute température, besoins de pureté maximale | Inertie supérieure, déplacement efficace de l'air, aucune formation de nitrure |
| Azote | Forte liaison triple, généralement non réactif, moins dense que l'air | Synthèse de routine, la plupart des organométalliques, applications sensibles au coût | Abondant, faible coût, largement disponible |
Besoin d'un four haute température fiable pour vos expériences sous atmosphère inerte ? KINTEK s'appuie sur une R&D exceptionnelle et une fabrication interne pour fournir des solutions avancées telles que les fours à moufle, tubulaires, rotatifs, sous vide et atmosphériques, ainsi que des systèmes CVD/PECVD. Avec de solides capacités de personnalisation approfondie, nous répondons précisément à vos exigences expérimentales uniques. Contactez-nous dès aujourd'hui pour améliorer l'efficacité et la sécurité de votre laboratoire !
Guide Visuel
Produits associés
- 1200℃ Four à atmosphère contrôlée d'azote inerte
- Four à atmosphère contrôlée à bande maillée Four à atmosphère inerte à l'azote
- 1700℃ Four à atmosphère contrôlée d'azote inerte
- 1400℃ Four à atmosphère contrôlée d'azote inerte
- Four à atmosphère inerte contrôlée d'azote et d'hydrogène
Les gens demandent aussi
- Comment une atmosphère inerte empêche-t-elle l'oxydation ? Protéger les matériaux des dommages causés par l'oxygène
- Que signifie inerte dans les atmosphères de four ? Protéger les matériaux de l'oxydation avec des gaz inertes.
- Quel est l'objectif principal du traitement thermique ? Transformer les propriétés des métaux pour des performances supérieures
- Comment fonctionne le traitement thermique sous atmosphère inerte ? Prévenir l'oxydation pour une qualité de matériau supérieure
- À quoi sert l'azote dans un four ? Prévenir l'oxydation et contrôler la qualité du traitement thermique



















